Détection des STEC dans les aliments
La détection des Escherichia coli produisant des Shiga Toxines (STEC) est peut-être l’un des sujets de microbiologie alimentaire les plus complexes du moment… c’est justement ce qui le rend passionnant.
L’objectif de cet article est d’expliquer le plus simplement possible ce qu’est un STEC, quelles sont les réglementations, mais surtout comment les détecter dans nos aliments.
Voici donc un article simple sur les STEC que même les chimistes devraient comprendre 😉
Sommaire :
- Qu’est-ce qu’un STEC ?
- Les conséquences d’une contamination d’aliments
- Quelles sont les matrices concernées
- La réglementation
- Détection des STEC dans les aliments : La norme ISO/TS 13136
- Les méthodes alternatives
- Conclusion
Découvrez les 5 meilleures PCR pour la détection des STEC
Nous avons sondé les SuperMicrobiologistes.
Voici les 5 PCR STEC préférées
Qu’est-ce qu’un STEC ?
Pour faire simple, un STEC c’est une souche d’Escherichia coli possédant le gène stx, responsable de la production de Shiga Toxines … mais si ce n’était que cela, ça serait trop simple ! Revenons donc à la base.
Les E. coli sont des bactéries, bacille à gram négatif, mesurant de 2 à 4 µm de long et d’un diamètre d’environ 0,6 µm. On les retrouve dans le tube digestif des animaux à sang chaud.
La majorité des E. coli n’est pas pathogène (heureusement), cependant, certaines souches de E. coli sont pathogènes pour l’homme, comme les STEC.
En ce qui concerne les souches STEC pathogènes, on a découvert que la plupart d’entre elles possédaient les gènes de virulence suivants :
- stx1 et stx2 : gène codant pour la production de shigatoxine.
- eae : gène codant pour l’intimine (qui est un facteur favorisant la pathogénicité de la souche).
Mais toutes les souches de E. coli possédant les gènes stx et eae ne sont pas toutes à l’origines de cas graves d’infections humaines à STEC. Pour déterminer les bactéries les plus pathogènes pour l’homme, on utilise les données épidémiologiques. Ces données font ressortir qu’en France, 5 sérotypes sont responsables de la majorité des infections (O157:H7, O26:H11, O103:H2, O111:H8, O145:H28). On parle du Big 5 ou de Top 5.
Toutes ces informations permettent de classer les E. coli (selon les définitions de l’ANSES):
| Gènes de virulence et sérotypes | Souches isolées dans les aliments |
| stx | STEC |
| stx et eae | STEC pathogènes |
| stx, eae et les 5 sérotypes (Big 5) | STEC hautement pathogènes (HP) |

Il existe donc 3 types de STEC; Les STEC, les STEC pathogènes et les STEC HP (hautement pathogènes).
Retrouvez notre cahier des charges pour la détection des STEC
Les conséquences d’une contamination d’aliments par un STEC
Si les contaminations aux STEC n’avaient aucun effet sur l’homme, on n’en parlerait pas…mais malheureusement ce n’est pas le cas.
Chaque année les STEC sont responsables d’1 million de malades et de 128 décès dans le monde, touchant principalement des enfants.
Le principal mode de contamination c’est l’ingestion d’aliments crus ou insuffisamment cuits … contaminés par des STEC (Les STEC sont facilement détruits par la chaleur).

Une contamination à STEC peut provoquer une “simple” diarrhée (même si tout le monde ayant déjà eu une diarrhée sait que ce n’est pas si simple que ça !).
Mais dans certains cas, et plus spécifiquement chez les enfants, une personne contaminée par un STEC peut souffrir de diarrhée sanglante, allant même jusqu’au Syndrome Hémolytique et Urémique (SHU), ce qui peut laisser des séquelles à vie (insuffisance rénale).
Quelles sont les matrices concernées par les STEC ?
Pour nous, microbiologistes, ce qui nous importe est de savoir quelles sont les matrices qui peuvent être potentiellement contaminées par des STEC. Cela nous permet de savoir quelles matrices tester.
Pour connaître les matrices concernées il faut regarder d’où viennent ces souches.
Les ruminants (bovins, ovins, caprins) sont considérés comme le réservoir majeur de ces pathogènes. Ils sont porteurs sains des STEC qu’on retrouve principalement dans leur tube digestif.
La contamination de “l’aliment” à lieu au moment de l’abattage pour la viande et au moment de la traite pour les produits laitiers (bactéries présentent dans les fèces se retrouvant sur le pis).
Les produits les plus susceptibles d’être contaminés par des STEC vont donc être les viandes consommées crues ou insuffisamment cuites et les fromages au lait cru (les STEC sont facilement éliminés par traitement thermique).
Il est également possible que des végétaux soient contaminés (par des épandages ou suite à une irrigation avec des eaux contaminées). Qui dit végétaux, dit produits dérivés de végétaux comme la farine (sujet hot du moment !).
Réglementation concernant les STEC
La seule réglementation qui existe concernant les STEC c’est le “paquet hygiène”. Le producteur est donc responsable de la qualité des produits qu’il met sur le marché.
Il a le choix des moyens, mais il a une obligation de résultat.
Il n’existe donc à ce jour aucun critère microbiologique pour la viande hachée, les végétaux* et les fromages au lait cru.
Pourquoi ? Les experts considèrent que la prévalence des STEC étant très faible, mettre un critère n’apporterait pas une réduction du risque pour le consommateur.
(*Le seul critère qui existe est pour les graines germées : absence dans 25g de STEC O157, O26, O111, O103, O145 et O104:H4, c’est ISO/TS 13136.)
En Europe chaque pays à ses propres guidelines. En France on a le guide d’aide à la gestion des alertes d’origine alimentaire. Celui-ci indique :
“En France, à la date de publication de ce guide, la définition des souches STEC isolées (c’est à dire mises en évidence à l’étape de confirmation de l’analyse) devant faire l’objet de mesures de gestion est la suivante : il s’agit des souches de E. coli possédant les gènes stx (stx1 ou stx2) ET eae ET appartenant à l’un des 5 sérotypes O157:H7, O26:H11, O145:H28, O103:H2, ou O111:H8”.
Dans d’autres pays, la gestion peut être différente :
UK : STEC Top 7
Allemagne, Suisse : Toutes les souches E. coli possédant un gène stx
Il faut donc faire attention lorsqu’on exporte un produit dans un pays qui a une réglementation différente.
Détection des STEC dans les aliments : La norme ISO/TS 13136
Comme on vient de le voir, il n’existe pas de réglementation concernant les STEC, par contre il y a une norme.
Cette norme c’est l’ISO 13136 (norme expérimentale), elle s’intitule : Microbiologie des aliments et aliments pour animaux – Méthode basée sur les réactions de polymérisation en chaîne (PCR) pour la recherche de micro-organismes pathogènes dans les aliments – Méthode horizontale pour la détection des E. coli producteurs de shiga-toxines (STEC) et la détermination des sérogroupes O157, O26, O103, O111 et O145.
Cette norme permet la détection des souches STEC HP (hautement pathogènes), possédant les gènes stx, eae et faisant partie des sérotypes du TOP 5 dans les aliments
La norme ISO propose un protocole de détection en 2 étapes :
- Dépistage (recherche des gènes de virulence et des sérotypes dans le bouillon d’enrichissement).
- Confirmation (on vérifie que les “marqueurs détectés par PCR dans l’étape précédente” proviennent d’une même bactérie, condition sine qua non pour considérer la bactérie comme un STEC HP).
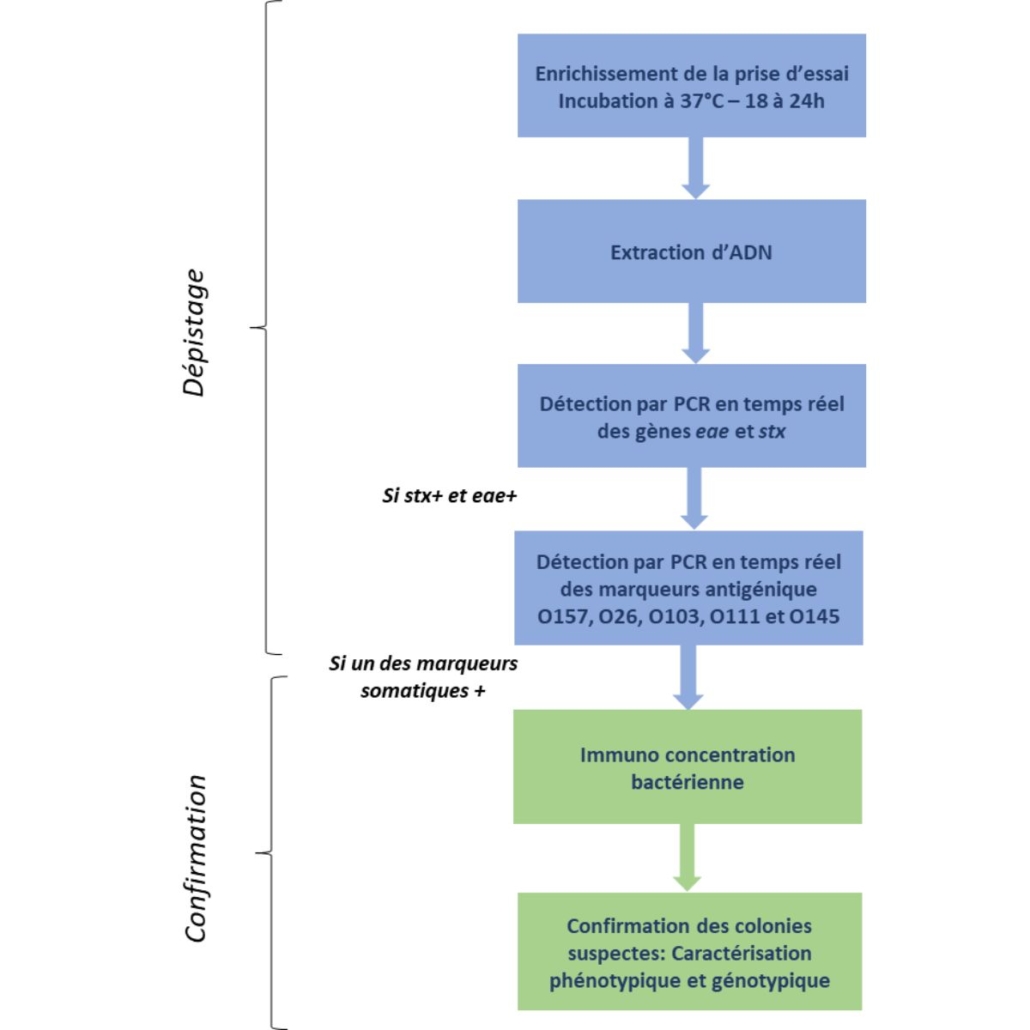
Enrichissement des STEC
En fonction de la nature de la matrice (fromage, viande, végétal) on choisira un bouillon d’enrichissement adapté. La norme en propose 3, de l’eau peptonée (EPT ou BPW) et 2 bouillons de tryptone de soja (TSB) supplémentés.
Le bouillon et la matrice sont ensuite incubés de 18 à 24h à 37° (nous avons eu confirmation que la norme allait évoluer, pour proposer une incubation à 41,5°C. Cela permet de limiter la croissance de la flore interférente).
Dépistage des STEC HP par PCR
Cette étape est aussi appelée “détection”.
Dans la norme ISO, la détection se fait en 2 temps :
Première PCR pour détecter la présence des gènes eae et stx :
- Si le résultat est négatif on peut arrêter l’analyse et rendre “absence de STEC”.
- Si le résultat est positif, on lance les autres PCR.
Deuxième PCR pour détecter la présence des marqueurs antigéniques du Top 5 (O157, O26, O103, 0111 et O145) :
- Si le résultat est négatif, on peut rendre “absence de STEC HP”.
- Si le résultat est positif, on doit lancer une confirmation.
Confirmation de la présence de STEC HP
Objectif de la confirmation : La confirmation permet de vérifier que les marqueurs détectés avec la PCR (gènes stx, eae et marqueurs du top5) proviennent d’une seule et même bactérie (condition sine qua non pour considérer l’échantillon positif à un STEC HP).
En effet, après l’extraction de l’ADN des cellules, les ADN de toutes les bactéries présentes dans le bouillon se retrouvent mélangés. La PCR ne permet pas de déterminer si les marqueurs viennent d’une ou de plusieurs bactéries.
Exemples :


L’objectif de la confirmation est donc d’isoler des colonies (à partir du bouillon) et de vérifier si ces colonies contiennent les 3 marqueurs.
A ce stade, on considère les échantillons positifs comme des suspicions de STEC HP.
Outils facilitant la confirmation : Immunoconcentration bactérienne
Après incubation le bouillon d’enrichissement contient une multitude de microorganismes, en repiquant un échantillon directement sur des milieux de culture gélosé on risquerait d’obtenir beaucoup de trop de colonies et de rendre la confirmation compliquée.
La norme ISO 13136 propose donc de passer par une étape d’immunoconcentration (aussi appelé IMS ou immuno-capture avec des billes magnétiques). Cette étape permet de faire une sélection des bactéries recherchées.
Le principe de l’IMS est simple. On utilise des billes magnétiques sur lesquelles on a accroché des anticorps. Ces anticorps vont capturer les bactéries appartenant aux sérotypes du Top 5 (complexes anticorps-antigènes). On récupère ensuite les billes (et les bactéries) pour faire un isolement sur un milieu gélosé spécifique (TBX ou milieux chromogéniques*).
*Le résultat PCR obtenu lors du dépistage nous donne l’information sur le(s) sérotypes présents. On peut alors choisir un milieu chromogènique spécifique au sérotype.
Confirmation des colonies suspectes
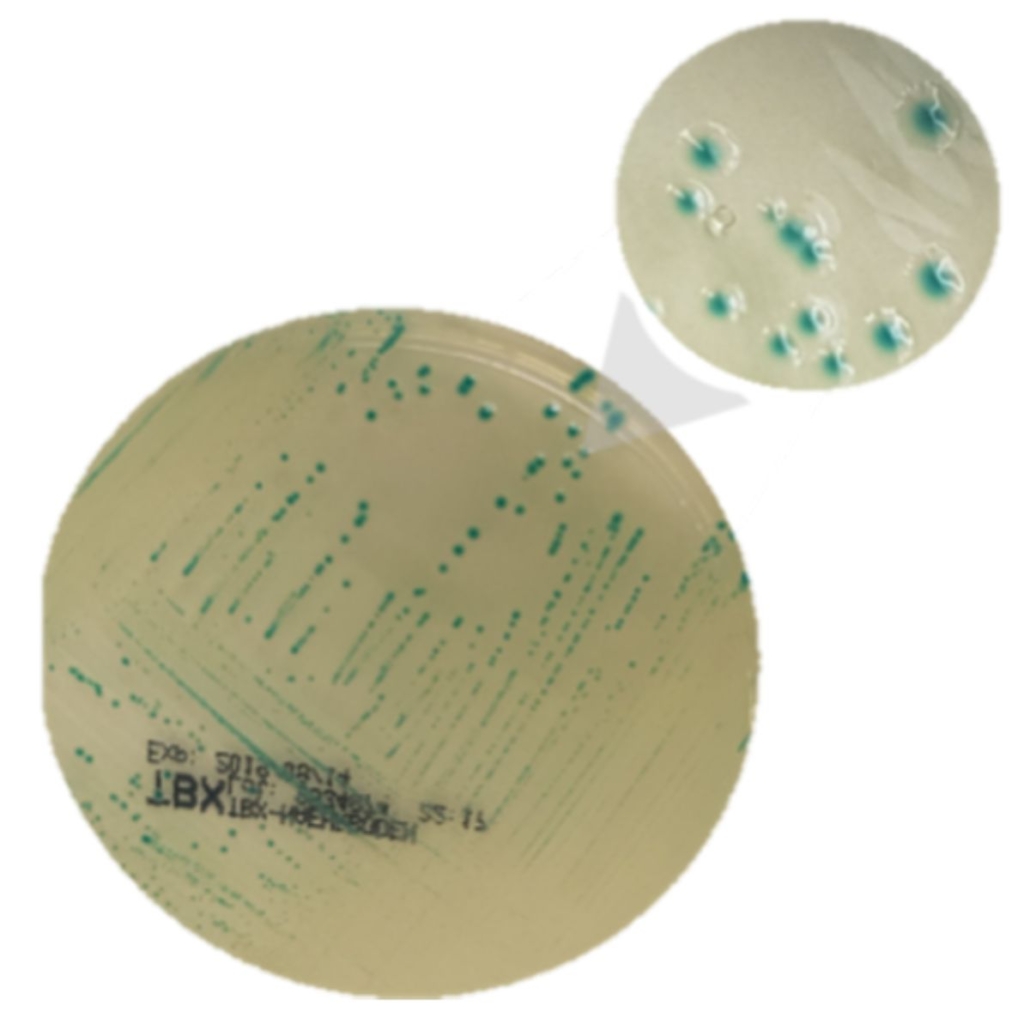
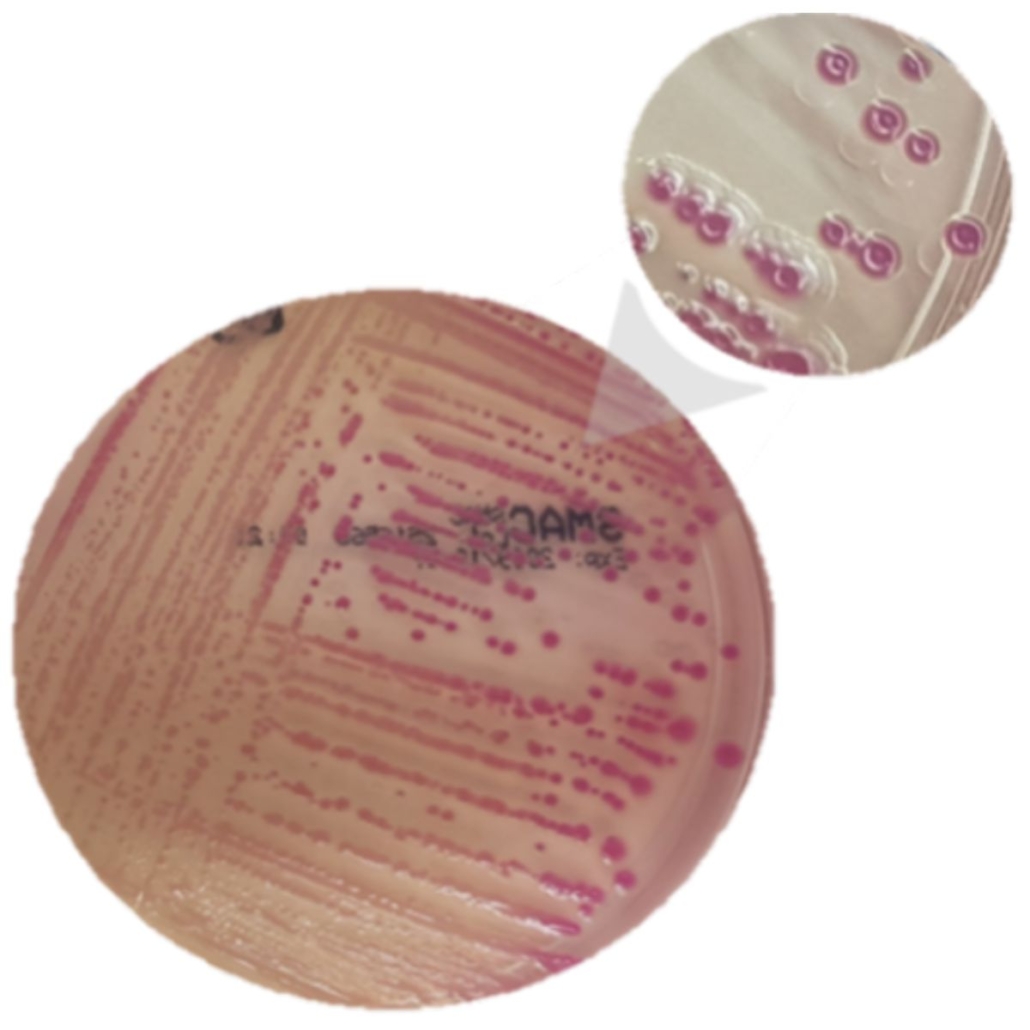
Après incubation des milieux de culture gélosés, pour chaque colonie caractéristique on doit caractériser les colonies de manière plus fine. Cette étape permettra de confirmer (ou pas) la présence des gènes stx et eae dans une même bactérie ainsi que leur appartenance au sérotype recherché.
Tant qu’on ne trouve pas de positif, on continue de récupérer des colonies et de lancer des PCR. La norme ISO 13136 indique qu’on doit rechercher un maximum de 50 colonies. Vous avez dit fastidieux ?
Les méthodes alternatives pour la détection des STEC
L’utilisation du protocole de la norme ISO/TS 13136 n’est pas une obligation. Il est possible d’utiliser une méthode alternative validée par tierce partie.
Ces méthodes proposées par des fournisseurs de kits ont bien souvent l’avantage d’être plus faciles à mettre en œuvre que la méthode ISO. Elles ont également l’avantage d’avoir été validées par un organisme indépendant AFNOR ou MICROVAL (ou AOAC). Ces méthodes ont toutes leurs points forts et leurs faiblesses… mais ça on en parlera dans un prochain article !
Si pour une raison ou pour une autre la méthode ISO ne convient pas (problème de pH, de flore interférente, etc…) Il est possible d’y apporter quelques modifications (modifier le bouillon, la température d’incubation, etc…). Pour cela vous pouvez vous appuyer sur le LNR (Laboratoire National de Référence pour les E.coli). Ils identifieront les étapes problématiques, proposerons des solutions.
Vous retrouverez dans cet article, le retour d’expérience de la fromagerie Chabert sur l’implémentation d’une méthode alternative de détection des STEC.
Conclusion concernant la détection des STEC
Sur le papier la détection des STEC peut sembler à peu près simple… mais dans la pratique ça ne l’est pas du tout, on vous explique pourquoi dans l’article “Pourquoi la détection des STEC est si compliquée ?”
Un grand merci à Delphine Sergentet (LNR) pour sa pédagogie lors de nos échanges.
Pour ne pas louper le prochain article, inscrivez-vous à la newsletter ici !












Laisser un commentaire
Rejoindre la discussion?N’hésitez pas à contribuer !