Guide d’achat STEC: Quelle méthode pour détecter les E.coli producteurs de shigatoxines ?
Des méthodes validées pour détecter les STEC hautement pathogènes dans les aliments il en existe moins de dix… mais ce n’est pas pour cela que le choix est plus facile.
Certaines de ces méthodes vont être plus ou moins bien adaptées à vos matrices et à votre laboratoire. Il est donc important de bien comprendre les enjeux avant de se lancer vers l’une ou l’autre de ces technologies.
L’objectif de cet article est de débroussailler un maximum le sujet pour vous aider à trouver LA méthode la plus adaptée à votre environnement.
Sommaire :
- Qu’est-ce qu’un STEC ?
- Quels sont les défis pour détecter un STEC ?
- Critères pour choisir une méthode de détection des STEC
- Comment choisir son fournisseur ?
Les 5 Meilleurs PCR STEC
Découvrez les 5 meilleures PCR pour la détection des STEC
Nous avons sondé les SuperMicrobiologistes.
Voici les 5 PCR STEC préférées
Qu’est-ce qu’un STEC ?
La définition d’un STEC est plus complexe qu’il n’y paraît, mais pour nous microbiologistes français, est considéré comme STEC HP (hautement pathogènes) une souche d’Escherichia coli possédant les gènes stx, eae et qui fait partie des 5 sérotypes retrouvés les plus fréquemment dans les cas cliniques; Le Top 5 (O157:H7, O26:H11, O145:H28, O103:H2 et O111:H8).

Si vous voulez impressionner vos ami.e.s microbiologistes à la pause-café, voici un article complet sur la définition des STEC.
Quels sont les défis pour détecter un STEC ?
La problématique dans la détection des STEC HP c’est qu’on cherche une bactérie qui possède les 3 gènes (stx, eae et O groupe).
Lorsque l’on fait une PCR, on lyse les bactéries pour récupérer l’ADN, lors de cette étape, tous les brins d’ADN de toutes les bactéries sont mélangés. Si la PCR détecte les 3 gènes, qui peut dire que ces 3 gènes proviennent de la même bactérie ? On considère ce résultat comme un présomptif positif.
Pour savoir si l’échantillon est vraiment positif, il faudra faire une confirmation en isolant les bactéries sur des géloses, puis en refaisant une PCR sur chaque colonie pour confirmer la présence des 3 gènes. Le véritable challenge des méthodes de détection STEC HP est de réduire le nombre de présomptifs positifs, de simplifier au maximum le protocole de confirmation tout en ne “loupant” aucun STEC.
Un sacré défi pour les fournisseurs !
Si vous voulez impressionner vos ami.e.s microbiologistes à l’apéro, voici un article complet sur la difficulté de détecter des STEC dans les aliments.
Critères pour choisir une méthode de détection des STEC
Toutes les méthodes vont avoir leurs points forts et leurs “faiblesses”. Il n’existe pas de “mauvaises” méthodes, il y a juste des méthodes qui vont être plus ou moins bien adaptées à votre laboratoire.
Passons maintenant en revue ces critères.
Éviter les faux négatifs
La chose la plus importante pour un laboratoire de contrôle qualité microbiologique c’est d’éviter les faux négatifs.
Opter pour une méthode validée ne vous prémunira pas à 100% de ce genre de problème (qui est souvent multifactoriel), mais au moins vous mettez toutes les chances de votre côté en utilisant une méthode reconnue pour ses performances.
Les 2 organismes de certifications européens qui ont validé des méthodes pour la détection des STEC sont l’AFNOR (4 méthodes STEC) et Microval (2 méthodes STEC). Ces 2 organismes se valent. Les études sont souvent faites dans les mêmes labos, avec le même référentiel (ISO 16140). Il n’y a que quelques petites différences que nous creuserons dans un prochain article.


Une méthode alternative est validée, uniquement si elle montre une supériorité ou une non-infériorité à la méthode ISO. C’est donc un véritable gage de qualité.
“Une méthode validée AFNOR ou Microval est un gage de performance” (Delphine Sergentet du LNR).
(Vous pouvez utiliser une méthode “non validée”, il en existe plusieurs. Cela ne signifie pas que la méthode est mauvaise, mais juste qu’elle n’a pas été validée par un organisme de certification. Dans ce cas, vous devrez mener votre propre validation pour vous assurer que cette méthode détecte correctement les STEC (c’est beaucoup de travail et de responsabilité… peu de labos se lancent dans ce genre de défi).)
Le dossier de validation
Sur le site internet des organismes d’accréditation vous trouverez le nom des méthodes validées et leurs dossiers de validation. Cela vaut vraiment la peine de s’y pencher, au moins pour vérifier que des matrices similaires aux vôtres ont été validées.
Bien entendu, cela ne vous exemptera pas de refaire une “validation” interne en suivant l’ISO 16140 (Microbiologie des aliments – Protocole pour la validation des méthodes alternatives). Sachant que toutes les matrices ont leurs propres spécificités (flore d’interférence, pH, % de matière grasse, etc…), cette validation vous permettra en autres de vérifier que vos matrices n’interfèrent pas avec la méthode alternative.
Conseil : Choisir une méthode qui a été validée par l’AFNOR ou MicroVal pour vos matrices (ou matrices similaires).
Réduire le nombre de présomptifs positifs
Une fois qu’on est “assuré” de ne pas avoir de faux négatifs, on souhaite choisir une méthode qui donnera le moins de présomptifs positifs possibles. Pour réduire le nombre de présomptifs positifs, parmi les méthodes validées AFNOR et MicroVal, certaines proposent une étape d’immunocapture (ou d’immunoconcentration) à faire avant la PCR.
L’immunocapture pré-PCR de dépistage
Il existe différents types d’immunocaptures qui peuvent se faire avec billes magnétiques, on parle alors d’IMS (Immuno-Magnétique Séparation) ou sans. Le principe de cette immunocapture est simple.
Dans le cadre d’une IMS utilise des billes magnétiques sur lesquelles sont accrochés des anticorps spécifiques aux E.coli du Top 5. Si dans l’échantillon il y a des souches du Top 5, les anticorps spécifiques vont s’y accrocher. Un aimant récupère ensuite les billes (et les bactéries Top 5 accrochées), ce qui permet de les séparer et de les extraire de l’échantillon.
L’étape d’immunocapture à lieu juste après la période d’incubation de la matrice dans le bouillon.


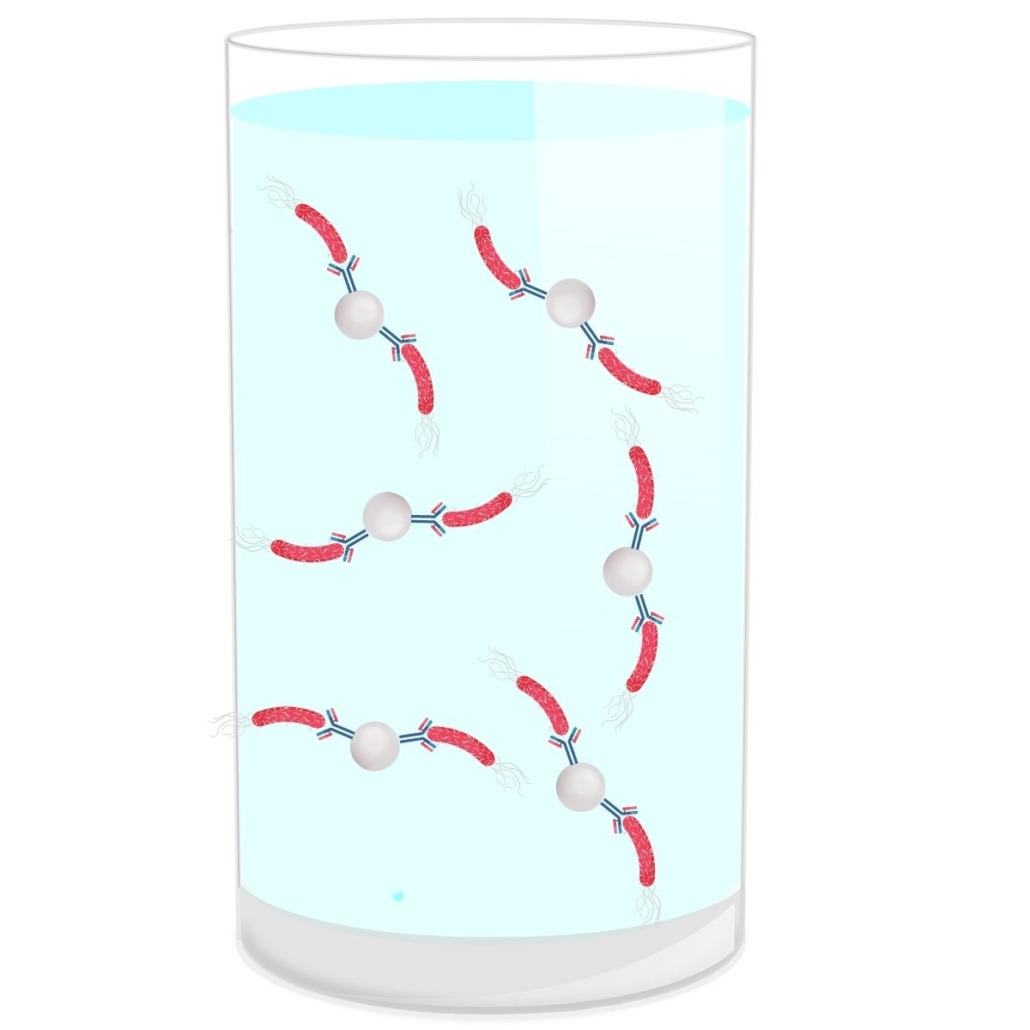
Les avantages de l’immunocapture :
- Premier tri : Cette étape permet d’éliminer tous les sérotypes qui ne font pas partie du Top 5 → réduction du nombre de présomptifs positifs.
- Rincer la matrice: Après capture, les bactéries du Top 5 sont rincées. Cela permet d’éliminer la matrice et donc les interférences et inhibitions potentielles lors de l’étape de PCR (réduction du nombre de faux négatifs). Cette étape permet également d’éliminer l’ADN libéré par les bactéries mortes (réduction des faux positifs).
Les inconvénients de l’immunocapture :
- Une manipulation de plus : Cette étape n’est pas compliquée et peut être automatisée, mais cela reste une étape… de plus.
- Attention pour l’export : Si vous exportez vos produits à l’étranger, cette méthode peut ne pas être compatible avec les réglementations locales. Exemple : L’Allemagne recherche uniquement les gènes stx+. Avec l’immunocapture on peut passer à côté d’une souche stx+ mais non Top 5.
L’immunoconcentration/IMS nous a semblé être actuellement l’étape la plus aboutie pour réduire le nombre de présomptifs. Mais nous restons en veille sur ce que pourrait proposer les fournisseurs (une méthode validée AOAC (USA) a une autre approche qui pourrait être très intéressante).
Conseil : Demander au fournisseur ce que sa méthode propose pour réduire le nombre de présomptifs positifs.
Simplifier la confirmation
Peu importe la méthode alternative que vous choisirez, vous aurez toujours un pourcentage de résultats présomptifs positifs pour lesquels il vous faudra confirmer.
Il y a ici 2 stratégies possibles :
- Sous-traiter la confirmation à un laboratoire agréé.
- Faire la confirmation dans votre laboratoire.
Attention, si vous optez pour la deuxième option il vous faudra un labo P2 plus ou P3 pour pouvoir traiter les échantillons.
Les protocoles de confirmation peuvent être longs, laborieux et coûteux. Il faut donc prendre en compte cette étape dans votre choix de méthode. L’enjeu de la confirmation est de retrouver le ou les sérotypes détectés lors de la PCR (dépistage) et de vérifier s’ils possèdent les gènes stx ET eae.
Voici les points à prendre en compte pour la confirmation :
Quel échantillon utilise-t-on pour la confirmation ?
Est-ce qu’il faut repartir du sac d’incubation (bouillon + matrice) ou de l’immunocapture pré-PCR (cela peut permettre de gagner une étape).
IMS post PCR
Est-elle manuelle ou automatisée ?
Les géloses à utiliser pour la confirmation
Quelles sont les géloses chromogéniques qu’il faut utiliser ? Certaines peuvent être plus performantes que d’autres.
Nombre de colonies à confirmer
Combien de colonies par boîte faut-il tester au maximum ? l’ISO indique 50, les méthodes validées entre 3 et 10.
Conseil : Demander aux fournisseurs de vous procurer un arbre de décision clair de la méthode ainsi que le protocole de discordance.
Ne pas oublier… moins vous aurez de présomptifs positifs, moins vous aurez de confirmations à faire.
La manipulation
Il y a quelques années, suivre un protocole de RT-PCR (real-Time PCR) c’était comme jouer au petit chimiste (ce que nous ne sommes (surtout) pas) !
Heureusement pour nous, les fournisseurs de kits ont fait d’énormes progrès et le nombre de pipetage (et donc de risque d’erreur) à fortement diminué. Il existe cependant des différences entre les protocoles des fournisseurs et cela peut être un véritable point différenciant entre les technologies.
Le Time to Decision (TTD)
Aujourd’hui les Time to Result sont plus ou moins tous les mêmes entre toutes les méthodes validées. Les durées d’incubation et de PCR sont quasiment identiques.
Ce qui va être différent c’est le TTD (Time To Décision) comme le dit si bien un certain François. B !
Le TTD, c’est le temps qu’il faut pour pouvoir prendre une décision concernant la libération ou non du produit. Pour les STEC étant donné qu’il y a les présomptifs et les confirmations, ce TTD est important… mais il peut être difficile à déterminer puisqu’il dépend de la flore de vos matrices. Si vous avez un historique de données, cela peut vous aider à simuler les TTD pour chaque méthode.
Température et Temps d’incubation
En fonction de la technologie et de la nature de votre matrice, le temps d’incubation peut varier. Pour la viande crue on va être autour de 8-24h et pour le lait cru 18-24h (voir les dossiers de validation pour chaque méthode).
En ce qui concerne la température d’incubation, pour les STEC tout le monde à l’air de s’accorder sur du 41,5°C (moins de flore interférente qu’à 37°C).
A ce jour l’ISO/TS 13136 indique une température d’incubation de 37°C, mais toutes les personnes que nous avons interrogées s’accordent à dire que dans la prochaine révision de la norme la température passera à 41,5°C.
Le bouillon d’enrichissement
Certains fournisseurs ont validé leur méthode avec de l’EPT simple (Eau Peptonnée Tamponnée ou BPW), d’autres avec de l’EPT modifiée.
Les questions à se poser sont :
- Est-ce que le bouillon modifié est propriétaire ? Qui peut me le fournir ?
- Est-ce qu’il est disponible dans un format compatible avec mon laboratoire (poches, poudres, flacons, etc…)?
- Est-ce qu’il est compatible avec la détection d’une autre souche, comme Salmonelle par exemple ? Cela permet d’utiliser le même bouillon.
Le nombre d’étapes de manipulation pour la PCR
Comme on le disait un peu plus haut, les protocoles de biologie moléculaire actuels sont beaucoup plus simples qu’avant, mais il reste tout de même quelques étapes.
Extraction d’ADN
Si l’extraction est nécessaire, combien de temps dure-t-elle ? Combien faut-il de pipetage ? De quels volumes parle-t-on ? Plus c’est petit en microlitres, plus il faut un “savoir-faire”
Pour certaines méthodes, l’extraction se fait directement dans le thermocycleur ou au moment de l’étape d’immunocapture pré-PCR.
Ajout des réactifs PCR
Le plus simple c’est quand les réactifs sont déjà dans le tube PCR (lyophilisés). Si ce n’est pas le cas, quelles sont les étapes et quels sont les volumes ?
Conseil : Combien faut-il de pipetage en tout ? Avec combien de pipettes différentes ?
Séquence des cycles de PCR
Toutes les méthodes ne sont pas égales sur ce point.
Par exemple pour la méthode ISO 13136 il y a 3 étapes de PCR :
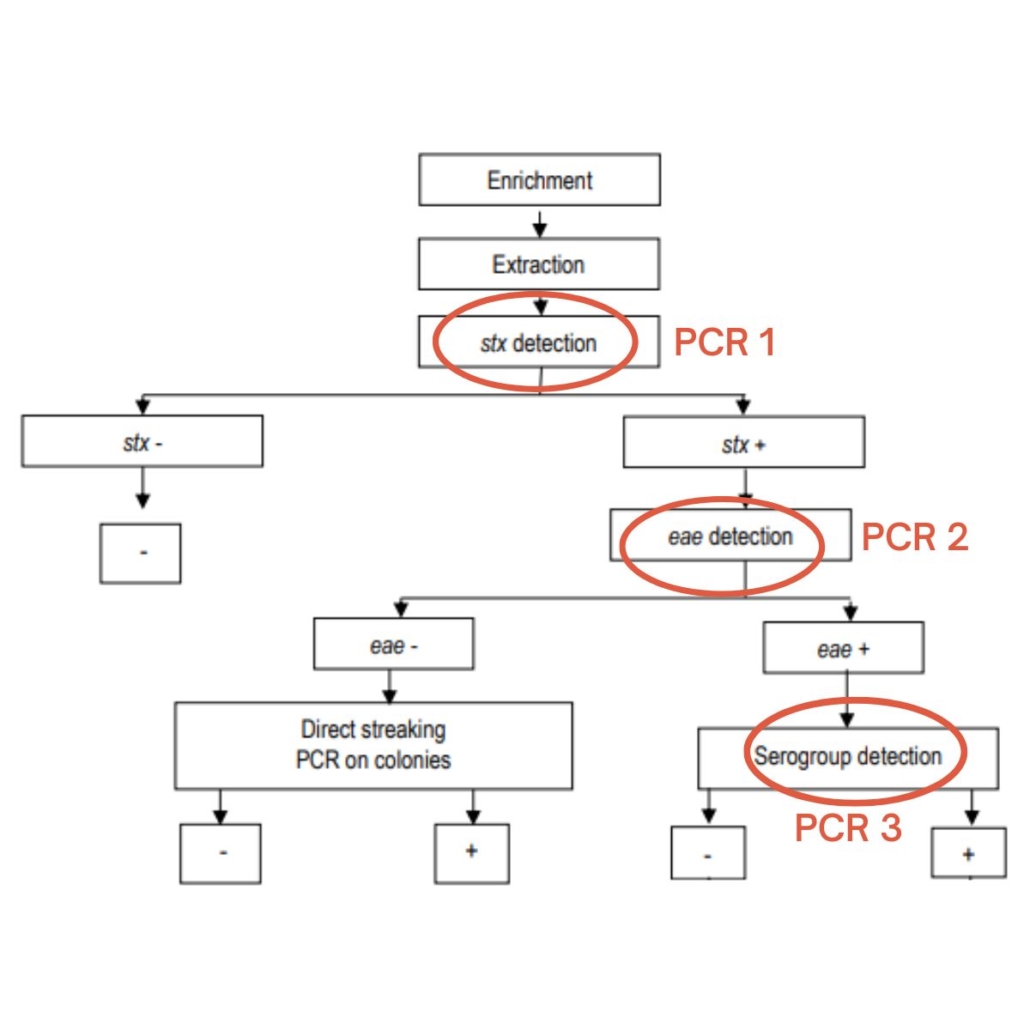
En ce qui concerne les méthodes alternatives validées, les stratégies sont différentes.
Certaines méthodes vont faire les 3 détections (eae, stx, top 5) avec 1 PCR, d’autres vont avoir une approche séquentielle en 2 ou 3 étapes (comme la méthode ISO).
- L’avantage de l’approche séquentielle c’est le prix. On ne lance que les PCR dont on a besoin.
- L’inconvénient c’est que pour les échantillons positifs on doit relancer d’autres cycles de PCR. Cela retarde le rendu du résultat et cela fait plus de manipulations.
Conseil : Demander au fournisseur de vous fournir un arbre de décision précis avec le prix et les durées de chaque PCR.
Si vous avez un historique sur la présence des gènes eae et stx dans vos matrices, cela pourra vous aider à faire des simulations.
Capacité et cadence analytique
En fonction de la capacité du thermocycleur vous pourrez lancer plus ou moins d’analyses. Il faut donc vérifier que le nombre d’analyses que vous avez à faire est compatible avec ce que peut proposer la technologie.
Il faut prendre en compte la potentielle utilisation du thermocycleur pour les confirmations. Vous pouvez également opter pour l’achat de 2 thermocycleurs au grand bonheur de votre fournisseur 😉
Analyses des résultats et logiciel
Pour la majorité des méthodes, on n’a pas besoin d’aller analyser les courbes et les CT pour savoir si une RT-PCR est positive ou négative. Les algorithmes s’en chargent pour nous.
Mais l’ergonomie du logiciel est tout de même un paramètre à prendre en compte qu’on néglige souvent.
Conseil : Demander au fournisseur de faire une démonstration du logiciel. Renseignez-vous également sur la connectivité de la technologie avec un LIMS.
Comment choisir son fournisseur de méthode pour la détection des STEC
Le prix
Le prix c’est bien souvent le nerf de la guerre. Et dans le cadre de l’analyse des STEC, il ne faut pas oublier de prendre en compte le prix et le coût de la confirmation (main d’œuvre et immobilisation de marchandise).
Conseil : Utiliser vos historiques d’analyses (% de stx, eae, Top 5) pour simuler au mieux vos coûts.
Le SAV
Un thermocycleur peut tomber en panne, dans ce cas que propose le fournisseur :
- Qui intervient (technicien SAV de la marque ou sous-traitant ou distributeur ?) et en combien de temps ?
- Que comprennent les contrats de maintenance, et à quel prix ?
Le support applicatif
Le support applicatif est peut-être ce qu’il y a de plus important (attention, le rédacteur de cet article est un ancien Ingénieur Application).
La formation
Il y a tout d’abord la formation de vos équipes sur la nouvelle méthode. Cette étape est primordiale pour la suite :
- Qui fera cette formation (un commercial, un ingénieur application, etc ?) ?
- Combien de temps dure-t-elle ?
- Combien de personnes peuvent la suivre ?
La validation
La norme ISO 16140 impose un cadre pour la validation des méthodes alternatives. Vous devrez donc y passer lors de l’adoption de votre nouvelle méthode de détection de STEC :
- Quel accompagnement propose le fournisseur ?
- A-t-il un protocole à vous fournir ?
- Sera-t-il présent pour les manipulations ou l’interprétation statistique des résultats ?
L’interprétation des résultats
Avec l’analyse des STEC vous aurez à un moment ou un autre des questions concernant les résultats. Le cas le plus courant est l’analyse des résultats discordants.
Exemple : Que faire quand on ne retrouve pas lors de la confirmation un sérotype détecté lors de l’étape de dépistage (PCR) ? Qui sera là pour vous aider ? Dans quelle langue ? Est-ce que le support se fera à distance ou une personne pourra se déplacer sur votre site ?
La confiance
Il reste un dernier argument, qui est le même pour toutes les technologies, c’est… la confiance que vous avez en votre fournisseur !
Cet argument peut paraître subjectif, mais il peut reposer sur des critères tangibles, comme :
- Est-ce facile de le joindre par téléphone ? Est-ce que vous tombez directement sur lui ou sur un serveur vocal ?
- Avez-vous déjà travaillé avec lui ? Si non, il faudrait se renseigner auprès d’un autre labo (sur LinkedIn ou via SuperMicrobiologistes)
- Est-il réactif, vous apporte-t-il rapidement une solution en cas de problème ?
Échanger avec d’autres utilisateurs de méthodes de détection des STEC
Choisir une méthode pour la détection des STEC n’est pas un choix anodin pour l’entreprise. Il ne faut donc rien laisser au hasard. Idéalement, avant de se lancer, il faut prendre le temps d’échanger et de rencontrer plusieurs utilisateurs de la technologie.
On évitera, si possible, les contacts donnés par le fournisseur. On pourra trouver d’autres utilisateurs sur un salon, sur LinkedIn, en réactivant un vieux copain de promo, ou en demandant sur le forum de SuperMicrobiologistes !
Une fois en contact, on en profitera pour échanger sur :
- Les performances de la technologie (est-ce que celles annoncées sont les mêmes que celles atteintes).
- La fiabilité de la technologie.
- Les “inconvénients” et les limites de la technologie. Les fournisseurs communiquent rarement là-dessus et pourtant toutes les technologies ont des limites. Connaître les limites permet de ne pas les dépasser !
Retrouvez dans cet article le retour d’expérience de la fromagerie Chabert.
Conclusion
On vous l’avait dit que la détection des STEC ce n’était pas du gâteau, mais maintenant, vous avez toutes les cartes en mains pour faire le meilleur choix.
Notre dernier conseil serait de faire des tests avant de vous décider. Testez vos différentes matrices, issues de différents moments de l’année avec la méthode PCR de votre choix. Pour cela, soit :
- vous avez les ressources en interne et vous faites ces tests dans votre laboratoire.
- vous externalisez cette étude dans un laboratoire prestataire expert (vous pouvez même peut-être négocier une petite prise en charge par le fournisseur de kits PCR !).
Vous avez maintenant toutes les cartes en main pour choisir la méthode de détection de STEC qui convient le mieux à votre labo, à vous de jouer !
Pour ne pas louper le prochain article, inscrivez-vous à la newsletter ici !

















Trackbacks (rétroliens) & Pingbacks
[…] Retrouvez notre cahier des charges pour la détection des STEC […]
Laisser un commentaire
Rejoindre la discussion?N’hésitez pas à contribuer !