Pourquoi la détection des STEC dans les aliments est-elle si compliquée ?
Que ce soit pour la norme ISO/TS 13136 ou pour les méthodes alternatives, la détection des souches d’Escherichia coli produisant des Shiga Toxines (STEC) est un sacré challenge.
On vous explique pourquoi.
Sommaire :
- Définition d’un STEC
- Risque de faux négatifs
- Risque de faux positif
- Les présomptifs positifs
- Conclusion
Avertissement : Pour traiter ce sujet « complexe » nous avons échangé avec le LNR, des experts indépendants, des utilisateurs de méthodes alternatives et des fournisseurs de kits. Cet article reflète donc notre compréhension du sujet. Si vous notez une coquille, écrivez-nous à pierre@supermicrobiologistes.fr. Nous mettrons régulièrement à jour cet article en y intégrant vos remarques.
Les 5 Meilleurs PCR STEC
Découvrez les 5 meilleures PCR pour la détection des STEC
Nous avons sondé les SuperMicrobiologistes.
Voici les 5 PCR STEC préférées
Qu’est-ce qu’un STEC ?
On a écrit un article complet (et simple) sur la définition du STEC.
Mais en résumé, en France, selon les saisines de l’ANSES et le guide d’aide à la gestion des alertes, on considère un aliment impropre à la consommation s’il contient des STEC hautement pathogènes (souche d’E. coli possédant les gène stx, eae et appartenant à l’un des 5 sérotype du Top 5 : O157:H7, O26:H11, O103:H2, O111:H8, O145:H28).
Retrouvez notre cahier des charges pour la détection des STEC
Risque de faux négatif lors de la détection des STEC HP
Le risque d’obtenir des faux résultats négatifs est certainement ce qu’il y a de pire pour un industriel. En effet, le fait de libérer un lot de produits contaminés peut engendrer un impact sur la santé des consommateurs et sur l’image de l’entreprise.
Ce risque de faux résultats négatifs est non négligeable dans le cadre de la détection des STEC HP.
Pourquoi ?
Tout simplement parce que les matrices à analyser sont complexes (rappel : fromage, viandes, végétaux). Ces matrices contiennent des inhibiteurs naturels (matière grasse, caractéristiques physico-chimiques comme le pH) ou des interférents (flore annexe) qui risquent de perturber la détection des STEC HP par PCR.
Certaines méthodes alternatives permettent d’atténuer l’effet matrice (bouillon spécifique, IMS, etc…). Cependant il faudra vérifier que la méthode a bien été validée avec vos matrices (comme presque toutes les matrices ont leurs particularités, une petite validation « maison » est fortement recommandée).
Risque de faux positif dans la détection des STEC HP
Un faux positif signifie que la PCR détecte un gène stx, eae et un sérotype du top 5 alors qu’il n’y en a pas dans l’échantillon. Etant donné la sensibilité des méthodes PCR utilisées aujourd’hui c’est peu probable.
Ce qui peut arriver en revanche, c’est que la PCR détecte de l’ADN de cellules mortes. Il faudra donc particulièrement faire attention à ce paramètre lorsque vous choisirez une technologie.
La confirmation des échantillons “présomptions positifs”
C’est certainement LE point qui cristallise aujourd’hui toutes les attentions, on vous explique pourquoi dans cet exemple :
| Echantillon 1 | Echantillon 2 |


| Résultat dépistage PCR : POSITIF | Résultat dépistage PCR : POSITIF |
| Présence de STEC HP : oui | Présence de STEC HP : non |
| Dans cet échantillon on a une bactérie possédant tous les marqueurs (stx, eae et le sérotype O26:H11). Après extraction les gènes vont se retrouver dans la même suspension, il s’agit d’un échantillon présomptif positif | Dans cet échantillon on a 3 bactéries, chacune portant un marqueur (stx, eae, et sérotype O26 : H11). Après extraction les gènes vont se retrouver dans la même suspension, il s’agit d’un échantillon présomptif positif |
Dans ces 2 cas le dépistage par PCR va rendre un résultat positif*. Pourtant seul l’échantillon 1 est réellement contaminé avec un STEC HP.
C’est pourquoi à la suite de l’étape de dépistage par PCR, on doit obligatoirement procéder à une confirmation, par isolement des bactéries sur géloses. Cela permet de vérifier si les 3 marqueurs proviennent d’une seule et même bactérie.
Le problème c’est que la présence de présomptions positifs n’est pas rare.
*En cas d’utilisation du protocole décrit dans la méthode décrite dans la norme ISO/TS 13136. Certaines méthodes alternatives permettent de diminuer le pourcentage d’échantillons présomptifs positifs.
Les techniques de confirmation
Chaque méthode propose un protocole spécifique pour la confirmation. Bien que différents, le principe général de ces protocoles de confirmation est basé sur le même principe :
Isoler des colonies pour vérifier si les 3 marqueurs proviennent d’une même bactérie
Pour confirmer, on repart du bouillon d’enrichissement, on fait un isolement sur un milieu de culture spécifique (milieux chromogéniques ou des milieux “sélectif” comme TBX).
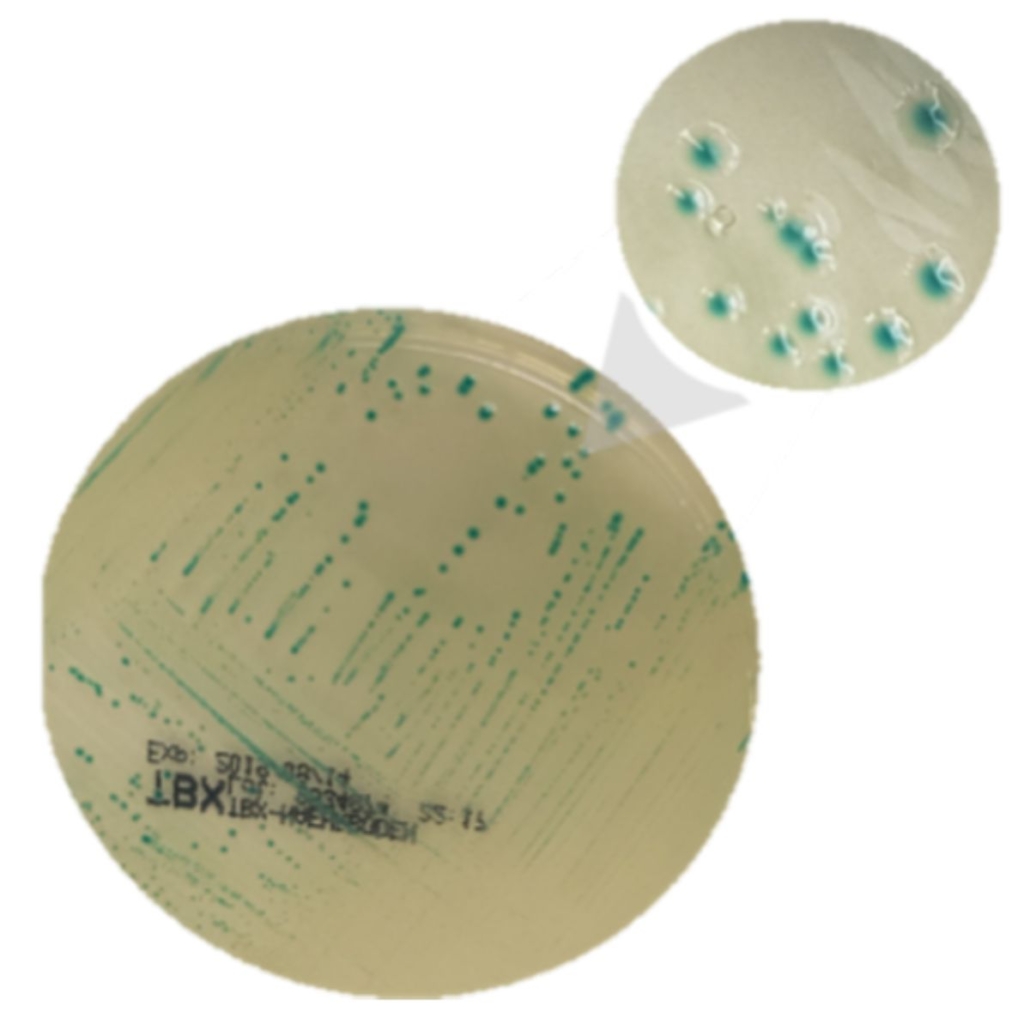
Une fois que les colonies sont visibles, on prélève les colonies caractéristiques et on lance une PCR. Si les 3 marqueurs sont présents alors il s’agit d’un positif STEC HP, sinon on continue en prélevant d’autres colonies.
La norme ISO 13136 demande de vérifier au maximum 50 colonies… ça fait du travail, n’est-ce pas ?!
Comme on vient de le voir, cette étape de confirmation est longue, laborieuse, coûteuse et demande une certaine expertise… Il ne faut pas oublier que pendant ce temps l’échantillon est considéré comme potentiellement positif, il ne peut donc pas être mis sur le marché (ou s’il l’est déjà il peut être soumis à un rappel !).
On comprend donc pourquoi la présence de présomptifs positifs lors du dépistage PCR peut-être une véritable problématique pour les industriels.
Conclusion
Le défi pour les méthodes alternatives va être de limiter le nombre de présomptifs positifs tout en évitant d’avoir des faux négatifs. On traite justement de ce sujet dans notre article “Comment choisir sa méthode de détection des STEC ?”
Un grand merci à Delphine Sergentet (LNR) pour sa pédagogie lors de nos échanges.
Pour ne pas louper le prochain article, inscrivez-vous à la newsletter ici !













Trackbacks (rétroliens) & Pingbacks
[…] Sur le papier la détection des STEC peut sembler à peu près simple… mais dans la pratique ça ne l’est pas du tout, on vous explique pourquoi dans l’article “Pourquoi la détection des STEC est si compliquée ?” […]
Laisser un commentaire
Rejoindre la discussion?N’hésitez pas à contribuer !