Microbiologie : 6 conseils pour un pipetage parfait
Si vous êtes sur le site de SuperMicrobiologistes, vous savez très certainement déjà manier la micropipette. On ne va donc pas vous réexpliquer les bases du pipetage.
L’objectif de cet article est de vous faire gagner quelques pourcentages de précision supplémentaires pour que vous soyez de véritables AS de la gâchette micropipette.
On a donc écumé les laboratoires de microbiologie et les sites de fournisseurs de micropipettes pour sélectionner les 6 conseils qui pourront faire la différence dans votre pipetage.
Les Meilleures Micropipettes
Découvrez les meilleures Micropipettes pour la microbiologie
Nous avons sondé les SuperMicrobiologistes.
Voici leurs marques de Micropipettes préférées
1 – La micropipette, n’est pas un marteau

Pour connecter le cône à la micropipette, il vaut mieux faire un mouvement rotatif que de taper dessus comme un goret.
Cela permet un meilleur positionnement du cône et cela facilitera son éjection.
2 – On n’enfonce pas (trop) le cône dans le liquide

Lorsque vous pipettez, il ne faut pas enfoncer le cône trop profondément dans le liquide. Idéalement il faut que la pointe du cône soit entre 2 et 4 mm en dessous de la surface du liquide.
Il y a 2 risques à trop enfoncer le cône :
- La profondeur va créer une pression importante sur le coussin d’air, il va se contracter et absorber un peu plus de liquide que demandé.
- Récupérer du liquide sur l’extérieur du cône.
Idéalement lors de l’aspiration il faut rester à la perpendiculaire du liquide. Plus vous inclinez la micropipette, plus le volume prélevé est inférieur à la consigne. Pas plus de 20° d’inclinaison.
3 – Pour une distribution parfaite
Distribution à la micropipette dans un tube
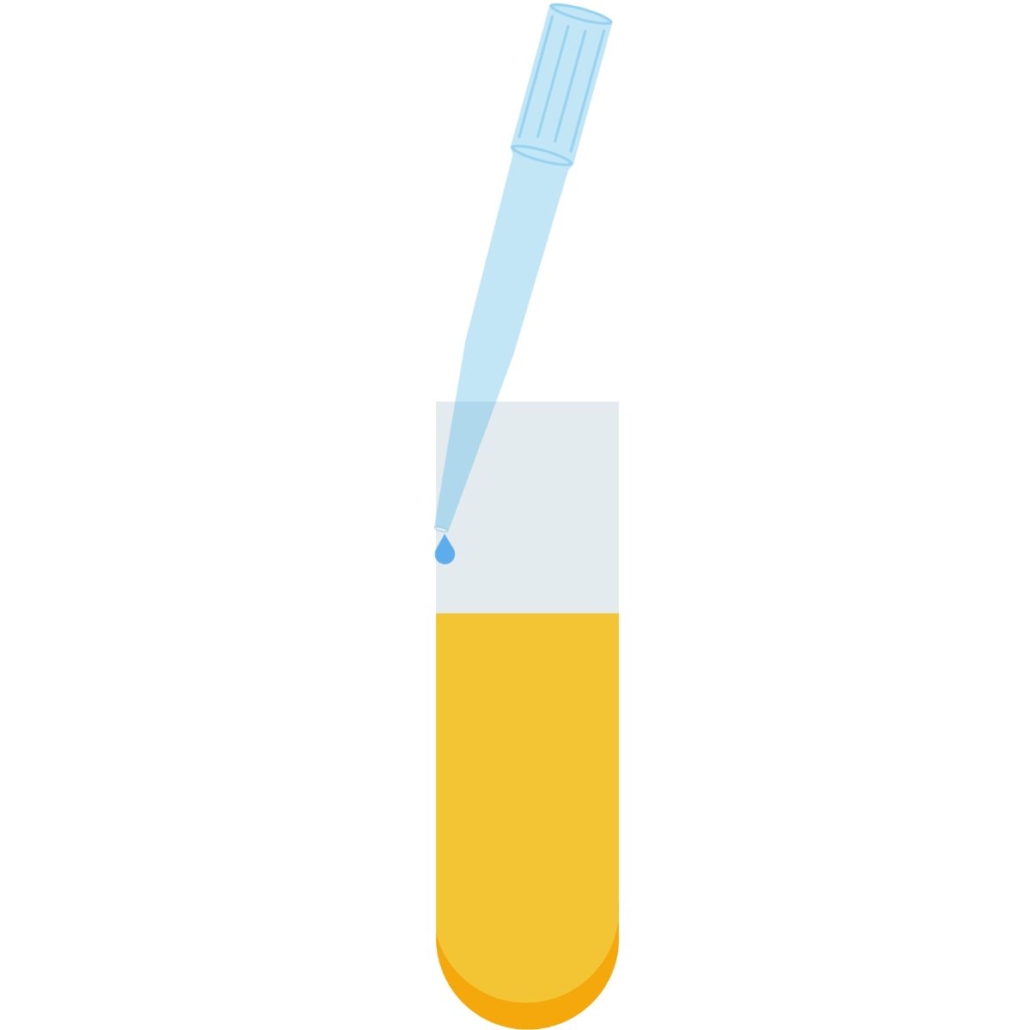
Idéalement il faut distribuer le liquide le long de la paroi, le cône doit légèrement se courber en touchant le bord du tube.
Cela permet de vider complètement le cône (ce qui est très important lorsqu’on manipule de petits volumes).
Distribution à la micropipette dans une boite de Petri

Pour distribuer dans une boîte de Petri, il est préférable de ne pas être perpendiculaire à la boite.
Optez plutôt pour une distribution avec un angle d’environ 45° (pas besoin d’un rapporteur non plus). L’angle de dépose permet de limiter l’effet de nébulisation.
On évitera également de toucher la surface de l’agar.
4 – On y va mollo sur le piston
Que ce soit lors de l’aspiration ou du refoulement du liquide, il ne faut pas faire de gestes brusques avec le piston.
Risque : Si on va trop vite, on peut soit faire des bulles au moment du refoulement, soit faire boire la pipette au moment de l’aspiration.
Et une pipette qui boit ce n’est pas bon du tout !!
5 – On pré-mouille les cônes
Qui pré-mouille ses cônes ?
C’est la question qu’on a justement posée aux SuperMicrobiologistes sur LinkedIN.
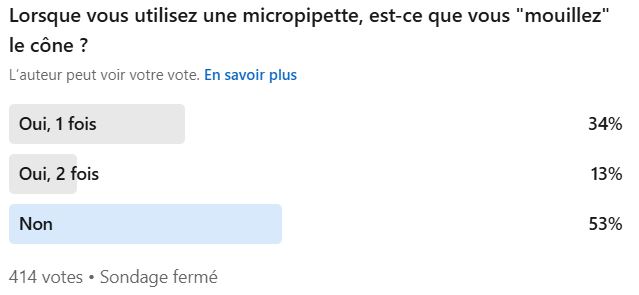
50% des SuperMicrobiologistes ne le font pas, et pourtant le pré-mouillage est obligatoire suivant la norme NF EN ISO 8655-2 (Appareils volumétriques à piston – Partie 2 : pipettes)… ahh on rigole moins là ?!
Pour pré-mouiller les cônes, on fait 2 à 3 aspirations/refoulements du liquide dans le cône.
Cette étape permet d’équilibrer la température entre le coussin d’air de la micropipette et le liquide. Cela permet de garantir la précision et la justesse du pipetage.
6 – On évite les variations de température
Idéalement (mais ce n’est pas toujours possible) il faudrait que le cône, la pipette et le liquide soient à la même température.
Les micropipettes qu’on utilise dans nos laboratoires de microbiologie sont des pipettes à coussin d’air (voir article). Le coussin d’air est garant de la précision du volume pipeté.
Donc si on pipette un liquide froid, on aura tendance à contracter le coussin d’air et donc à prélever plus de liquide que voulu.
Au contraire, avec un liquide chaud, on aura tendance à dilater le coussin d’air et donc à prélever moins de liquide que voulu.
Bonus 1 : Pour les micropipettes à volume variables
Pour les pipettes à volume variable, on n’évitera d’aller en dessous des 35% du volume nominal.

Les micropipettes à volume variable peuvent couvrir des volumes allant de 100% à 10% du volume nominal. Cependant entre 35% et 10% on perd en exactitude.
Bonus 2 : Pour les liquides visqueux ou volatiles
Lorsqu’on a affaire à des matrices non aqueuses ou moussantes (ex : glycérine, éthanol) il faut utiliser le pipetage inversé.
C’est beaucoup plus précis et on peut le faire avec toutes les micropipettes. On a même écrit un article complet sur le pipetage inversé.
Si vous aussi vous avez d’autres astuces, venez les partager en commentaire.
Pour ne pas louper le prochain article, inscrivez-vous à la newsletter ici !













Laisser un commentaire
Rejoindre la discussion?N’hésitez pas à contribuer !