Microbiologie : Comment décontaminer le crible d’un biocollecteur entre deux prélèvements ?
Quand vous partez pour une campagne de prélèvements d’air, ce n’est jamais pour un seul échantillon.
Vous préparez votre plan de contrôle (papier ou numérique), vous prenez votre biocollecteur bien chargé (ça aide !) et vos boîtes de gélose, et c’est parti pour quelques heures en zone de production.

Mais entre deux prélèvements, pour éviter les contaminations croisées, comment assurez-vous la propreté microbiologique du crible de votre biocollecteur ?
C’est exactement la question que nous avons posée aux SuperMicrobiologistes. Et comme vous allez le découvrir dans cet article, des solutions existent et elles sont variées… comme on les aime !
Découvrez les 2 meilleurs biocollecteurs d’air pharma
Nous avons sondé les SuperMicrobiologistes.
Voici leurs marques de biocollecteurs préférées
Utiliser des cribles à usage unique
Certains fournisseurs de biocollecteurs proposent des cribles stériles, emballés individuellement et prêts à l’emploi.
Une fois sur le lieu du prélèvement, vous ouvrez l’emballage, faites votre prélèvement, puis jetez le crible.
Bien sûr, cette solution a un coût, non seulement financier, mais aussi environnemental. Cependant, elle peut s’avérer très utile dans les zones sensibles (stériles) ou en cas de panne d’autoclave (eh oui ça arrive !).
Cette méthode est principalement utilisée dans les laboratoires pharmaceutiques.
Stériliser les grilles du biocollecteur entre chaque prélèvement
Dans certaines zones critiques pharmaceutiques (salles propres / blanches de grade A et B), il est impensable de simplement « nettoyer » les cribles entre les prélèvements.
Il est alors impératif d’utiliser des cribles stériles, qui ont été préalablement autoclavés par le laboratoire. Chaque crible est utilisé pour un prélèvement.
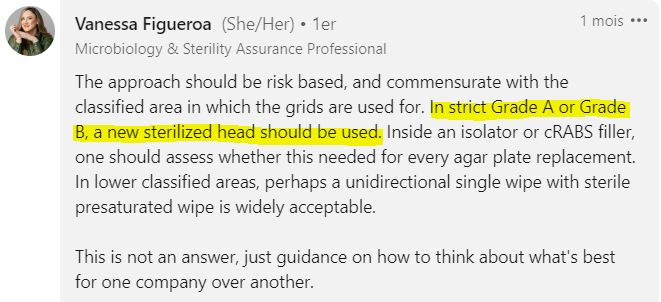
“En zone de grade A ou B strict, un crible stérile doit être utilisée. »
Pour les prélèvements en isolateurs ou RABS (Restricted Access Barrier System), la question du remplacement du crible entre chaque prélèvement peut se poser.
Effectivement dans ces zones stériles, la contamination croisée est extrêmement rare et si cela devait arriver cela donnerait tout de même une information importante “il y a une contamination alors qu’il ne devrait pas en avoir” !

“Selon moi, dans les systèmes RABS et isolateurs, une fois stérilisés avant le chargement, il ne devrait pas être nécessaire de désinfecter entre les prélèvements, puisque tout facteur de contamination devrait être détecté en zone de grade A. ”
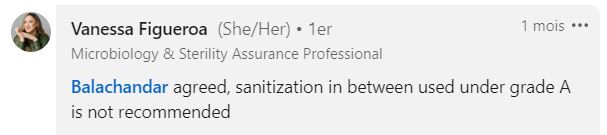
“Je suis d’accord, la désinfection entre 2 prélèvements en zone de grade A n’est pas recommandée. »
Comment stériliser les cribles ?
La stérilisation par autoclavage ne dispense pas d’un “nettoyage” préalable du crible.
Voici les étapes recommandées par un SuperMicrobiologiste :
- Nettoyage manuel avec EPI (eau pour solution injectable)
- Séchage
- Désinfection manuelle IPA (alcool isopropylique)
- Ensachage puis stérilisation en autoclave
Peut-on utiliser plusieurs grilles par biocollecteur ?
Oui, il est tout à fait possible d’avoir plusieurs cribles par biocollecteur, et c’est même la solution privilégiée par de nombreux laboratoires, comme l’a révélé notre sondage :
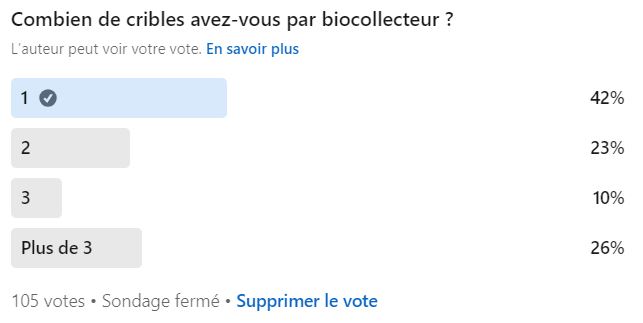
Vous partez donc en campagne de prélèvements avec plusieurs cribles autoclavés, et vous en utilisez un différent pour chaque prélèvement.
Attention si vous optez pour cette méthode :
- Votre biocollecteur doit être calibré avec tous les cribles qui lui sont attribués (ce qui peut augmenter le coût de la calibration).
- Une traçabilité précise des cribles peut etre demandé : vous devez pouvoir identifier quel crible a été utilisé pour quel prélèvement. Les cribles doivent donc être numérotés et facilement reconnaissables.
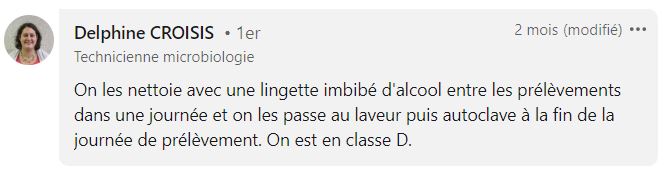
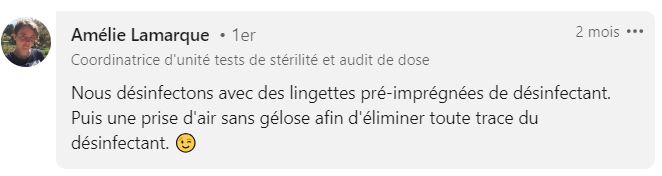
Utiliser des lingettes désinfectantes entre les prélèvements
L’idéal pour éviter les contaminations croisées serait d’utiliser un crible stérile à chaque prélèvement… mais entre l’idéal et la réalité, il y a parfois un écart.
De nombreux SuperMicrobiologistes, issus de secteurs variés (pharmaceutique, hygiène hospitalière, agroalimentaire, cosmétique), nous ont confié qu’ils utilisent des lingettes imbibées pour désinfecter leurs cribles entre chaque prélèvement.
Quel type de lingette utiliser ?
Les pratiques sont assez uniformes. En général, vous commencez la campagne de prélèvement avec un crible stérile, puis vous utilisez une lingette pour désinfecter le crible entre chaque prélèvement.
Les options couramment utilisées sont :
- Lingettes imbibées d’alcool à 70%
- Lingettes prêtes à l’emploi avec biocide (bactéricide et fongicide, attention au temps de contact !)
Attention aux résidus des lingettes
Lorsque vous utilisez des lingettes désinfectantes, il est crucial de faire attention aux résidus qu’elles peuvent laisser.
On distingue deux types de résidus :
Les résidus physique (fibres)
Lorsque vous nettoyez une grille de biocollecteur avec une lingette, il se peut que des fibres se logent dans les trous du crible, risquant ainsi de fausser le prélèvement suivant. Il est donc essentiel de choisir des lingettes qui ne libèrent pas de fibres.
Un autre point à surveiller : certains trous de cribles peuvent être mal « limés », avec de petites aspérités qui abîment la lingette et collectent des fibres (pouvant même percer des gants ou blesser des microbiologistes !).
Si c’est le cas, il est recommandé de contacter votre fournisseur de biocollecteur, car cela signifie que le crible n’est pas conforme.
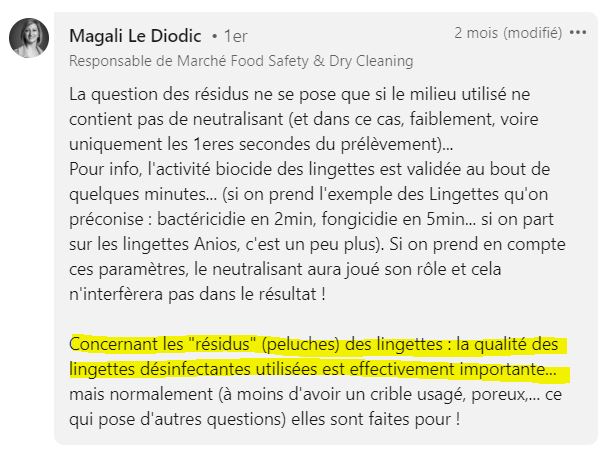
Les résidus chimiques
Si des résidus chimiques restent sur vos cribles, ils risquent de se retrouver sur votre gélose et d’affecter la croissance microbienne, ce qui pourrait avoir un impact sur la croissance microbienne. Le risque serait alors de sous-évaluer votre population.
Si vous utilisez des lingettes imbibées d’alcool, il est important de laisser l’alcool s’évaporer complètement avant de procéder au prélèvement suivant. Certains accélèrent le séchage en effectuant un petit cycle d’aspiration du biocollecteur sans gélose, mais attention au risque de… recontamination !
Si vous utilisez des lingettes imbibées de biocides, vous devrez évaluer l’impact des résidus sur vos échantillons, ce qui peut être complexe. Vérifiez d’abord si votre milieu de culture contient des neutralisants, et s’ils sont efficaces contre le désinfectant utilisé.
Autres conseils pour les lingettes
Voici quelques autres conseils que nous avons glané sur l’utilisation des lingettes :
- Vous pouvez utiliser un crible stérile différent pour chaque zone (ou salle), puis entre les prélèvements d’une même salle vous le désinfectez avec une lingette.
- Il est préférable, si possible, de commencer par la zone la moins contaminée et de progresser vers la zone la plus « sale ».
- Lorsque vous utilisez la lingette, veillez à nettoyer non seulement la surface extérieure du crible, mais également l’intérieur. Au passage un petit coup sur le biocollecteur ça ne mange pas de pain !
Conclusion
Vous disposez désormais d’un large éventail de solutions pour effectuer plusieurs prélèvements consécutifs avec un biocollecteur.
Il n’existe (malheureusement) pas de solution universelle. En vous appuyant sur votre connaissance des locaux, le nombre de prélèvements à effectuer et leur criticité, vous pourrez analyser les risques et choisir la méthode la plus adaptée.
Il est même fortement possible que vous optiez pour une combinaison de plusieurs approches.
Dites-nous en commentaire quelle est votre stratégie !
Un grand merci à tous les SuperMicrobiologistes qui ont pris le temps de partager leurs expériences avec nous !
Pour ne pas louper le prochain article, inscrivez-vous à la newsletter ici !












Laisser un commentaire
Rejoindre la discussion?N’hésitez pas à contribuer !